Les mini-plasmides pFAR pour la Thérapie Génique et cellulaire – Recherche, développement et aspect translationnel
Les approches de thérapie génique non virale impliquent notamment l’utilisation de plasmides comme vecteurs de gènes pour la Thérapie Génique et Cellulaire. Afin de répondre aux recommandations des autorités réglementaires qui préconisent l’élimination des gènes de résistance aux antibiotiques des plasmides, notre groupe a développé une stratégie permettant de sélectionner les bactéries productrices des mini-plasmides pFAR4 (Free of Antibiotic Resistance)1. En comparaison avec les vecteurs de gène couramment utilisés, les plasmides pFAR4 présentent un potentiel d’expression génique supérieur dans différents tissus2,3.
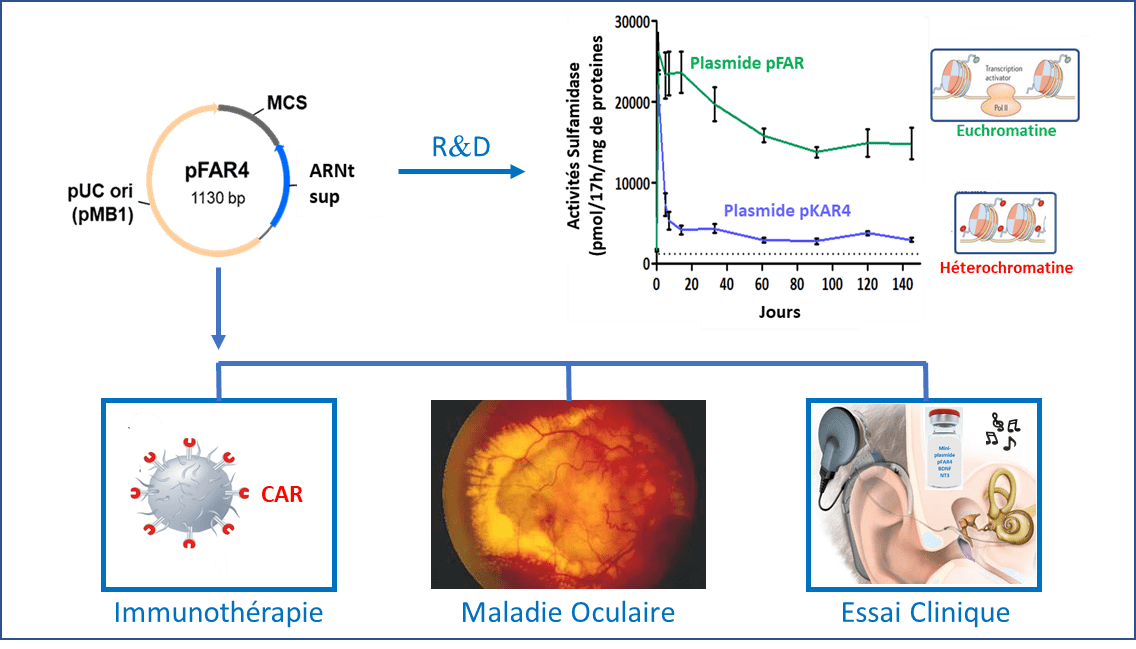
Les miniplasmides pFAR sont dépourvus de gène de résistance aux antibiotiques.
Leur potentiel a été démontré in vitro et in vivo dans différents organes tels que le foie. A l’oppose des plasmides conventionnels portant un gène de résistance à la kanamycine (pKAR4), le plasmide pFAR4 est protégé des phénomènes d’extinction du transgène et de la formation d’hétérochromatine.
Les exemples d’application sont nombreux et couvrent :
– l’Immunothérapie et la production de CAR-T et CAR-NK cells qui consistent à modifier génétiquement des cellules du système immunitaire pour l’expression d’un récepteur chimérique (CAR) d’un antigène présent à la surface des cellules tumorales,
– Les maladies oculaires telles que la dégénérescence maculaire liée à l’âge néovasculaire,
– l’utilisation d’un plasmide pFAR4 codant les facteurs neurotrophiques BDNF et NT3 dans l’optique d’augmenter les performances d’implant cochléaire et l’appréciation de la musique chez les patients traités (essai clinique de Phase I/II en cours).
Suite au développement des plasmides pFAR4, deux axes principaux d’amélioration ont été menés :
Le premier a consisté en l’identification d’un milieu de culture chimiquement défini visant à optimiser la production des plasmides pFAR4 de qualité recherche ou clinique. Ces travaux se sont inscrits dans un programme de pré-maturation financé par CNRS-Innovation.
Le second axe d’amélioration a consisté à promouvoir l’expression prolongée du transgène dans les cellules eucaryotes en division, en fusionnant le vecteur pFAR4 avec les composants du système de transposon Sleeping Beauty (SB) qui assure l’intégration du transgène dans le génome des cellules transfectées. Par rapport à d’autres vecteurs, cette combinaison s’est avérée supérieure en termes d’efficacité de transfert de gènes dans de nombreux types cellulaires4-8.
Collaborations en cours dans le cadre d’essais cliniques de thérapie génique
- Traitement des troubles de l’audition. Le projet collaboratif initié avec l’équipe du Pr Gary Housley (UNSW, Sydney, Australie) vise à améliorer, chez les patients atteints de surdité héréditaire ou acquise, les performances des implants cochléaires. L’approche innovante consiste à utiliser une nouvelle technologie permettant de focaliser le champ électrique (‘Bionic array Directed Gene Electrotransfer’ : BaDGE®) nécessaire à la transfection des cellules mésenchymateuses tapissant le compartiment péri-lymphatique cochléaire avec un plasmide pFAR4 codant les facteurs neurotrophiques BDNF et NT3. La sécrétion de ces protéines recombinantes stimule la régénération ciblée des neurites périphériques des neurones du ganglion spiral pour combler l’espace neuronal existant entre l’implant cochléaire et les fibres du nerf auditif chez les patients atteints de surdité. Des résultats précliniques très prometteurs ayant été obtenus chez l’animal9, un premier essai clinique de phase I/II a été initié fin 2020 (www.CINGT.info ; #ACTRN12618001556235). Chez les 16 patients traités, aucun événement indésirable n’a été détecté validant ainsi l’innocuité de l’approche thérapeutique.
Une description de l’essai clinique en cours et le témoignage des patients traités peuvent être visualisés en suivant ce lien dirigeant vers un reportage diffusé à la télévision australienne :
Le lancement de cette étude est le résultat d’une collaboration fructueuse initiée en 2015 entre l’UTCBS et l’équipe UNSW dirigée par le Pr. Gary Housley, en partenariat avec Cochlear Ltd, des collaborateurs de NextSense localisés à Sydney, l’Université de Sydney et le Centre de l’audition de l’Université de Macquarie.
- Traitement de la dégénérescence maculaire liée à l’âge (DMLA). L’excellente performance des plasmides pFAR en tant que vecteurs d’expression non viraux dans les cellules épithéliales pigmentaires humaines de la rétine (RPE) et de l’iris (IPE) a conduit à leur sélection pour la préparation d’un essai clinique de phase I/II. Celui-ci est basé sur la transfection ex vivo de cellules IPE autologues, en utilisant la technologie pFAR4/transposon afin d’exprimer le facteur PEDF (facteur de l’épithélium pigmentaire), suivie d’une implantation sous-rétinienne des cellules génétiquement modifiées. L’augmentation locale des niveaux de PEDF a pour objectif de contrebalancer l’effet délétère de la néovascularisation médiée par le VEGF chez les patients atteints de DMLA néovasculaire. Ces travaux sont menés en collaboration avec le groupe du Pr. G. Thumann et les partenaires du projet européen TargetAMD4,6,7.
Projets de recherche pré-clinique programmés ou déjà initiés
- Thérapie génique cornéenne en collaboration avec le Pr Eric. Gabison, (Fondation Rothschild d’Ophtalmologie, Paris). Il s’agit de développer une thérapie régénérative cellulaire/génique des maladies sévères de la cornée telles que l’épidermolyse bulleuse dystrophique récessive ou l’aniridie sous forme de gouttes oculaires contenant des vésicules extracellulaires (VE) capables de délivrer des molécules thérapeutiques à la surface oculaire. Le projet prévoit de modifier génétiquement des cellules souches mésenchymateuses (issues de sang de cordon) en utilisant la technologie pFAR4/transposon afin qu’elles sur-expriment PAX6 ou COL7 (gènes mutés ou déficients dans les maladies les plus sévères de la surface oculaire). Ces CSM génétiquement modifiées seront la source des VE thérapeutiques. Un financement par l’AFM-Téléthon a été obtenu pour ce projet (2023-2026).
- Projet d’immunothérapie CAR-NK comme nouveau traitement du myélome multiple utilisant la technologie pFAR4/transposon et ciblant l’antigène tumoral BCMA. Notre étude prévoit de répondre à trois des principales limitations des CAR-NK, à savoir leur faible taux de transduction, leur faible capacité de prolifération ex vivo pendant le processus de production ainsi que leur faible persistance in vivo après administration au patient. Il s’agit d’une collaboration inter-équipes UTCBS. Un premier contrat associatif a été obtenu en 2023.
Pour aller plus loin
Références
1Marie C. et al., 2010. J. Gene Med., 12: 323-332
2Pastor, M. et al., 2020. Mol. Ther Nucleic Acids. 21: 28 ;
3Quiviger, M. et al. 2014. Gene Ther. 21(12): 1001
4Hernandez, et al., 2019. Mol. Ther.-Meth & Clinic. Dev. J., 15: 403
5Pastor, et al., 2018. Mol Ther Nucleic Acids. 11: 57
6Garcia-Garcia, et al., 2017. Mol Ther Nucleic Acids. 9:1
7Thumann, et al., 2017. Mol Ther Nucleic Acids. 6: 302.
8Gogishvili et al., 2017, ESGCT XXV Anniversary Congress, Berlin, Allemagne (P052)
9Pinyon et al., 2019. Hearing Res. 380: 37e149
Axe de recherche sous la responsabilité du Dr Corinne MARIE
À lire aussi

October 2025 – Thesis defense at UTCBS: Mitta PIERRE
On October 1st, 2025, Mitta PIERRE successfully defended her doctoral thesis entitled “Nanoformulations of antioxidant active ingredients for ophthalmic administration in the prevention of age-related macular degeneration (AMD)”
Sept 2025 – [Keynote recherche] Nathalie Mignet, Nanomédicaments et nanoparticules lipidiques pour la délivrance d’acide nucléique
La keynote de Nathalie Mignet, Directrice de l’UTCBS est en ligne!

Juillet 2025 – Workshop du master erasmus mundus Nanomed
Le workshop du master erasmus mundus Nanomed s est tenu à la faculté de pharmacie du 8 au 10 juillet.

Juin 2025 – Le congrès des Apprentis Chercheurs d’Université Paris Cité a eu lieu en juin dernier avec la participation de l’UTCBS
Le congrès des Apprentis Chercheurs d’Université Paris Cité a eu lieu en juin dernier avec la participation de l’UTCBS
